Wieloośrodkowe, randomizowane badanie fazy III prowadzone metodą podwójnie ślepej próby w grupach równoległych, z grupą kontrolną otrzymującą placebo, oceniające skuteczność i bezpieczeństwo stosowania trontinemabu u uczestników z wczesnymi objawami choroby Alzheimera (łagodne zaburzenia funkcji poznawczych do łagodnego otępienia spowodowanego chorobą Alzheimera)
Badanie mające na celu porównanie skuteczności trontinemabu z placebo u osób z wczesnymi objawami choroby Alzheimera
Choroba neurodegeneracyjna Choroba Alzheimera (AD)
Podstawowe informacje
W tym badaniu testowany jest lek o nazwie trontinemab. Ma on za zadanie usuwanie blaszek amyloidowych z mózgu i jest opracowywany w celu leczenia wczesnych objawów AD.
Trontinemab jest lekiem eksperymentalnym. Oznacza to, że organy ds. zdrowia (takie jak Amerykańska Agencja ds. Żywności i Leków [FDA] oraz Europejska Agencja Leków [EMA]) nie zatwierdziły trontinemabu do stosowania w leczeniu choroby Alzheimera.
Celem tego badania jest porównanie skuteczności i bezpieczeństwa trontinemabu z lekiem nieaktywnym (placebo) u osób we wczesnym stadium choroby Alzheimera.
2. Kto może wziąć udział w badaniu?
W badaniu mogą wziąć udział osoby (mężczyźni i kobiety) w wieku 50-90 lat z AD, jeśli mają niewielkie problemy z pamięcią lub myśleniem lub jeśli problemy te zaczęły wpływać na ich pracę lub codzienne czynności. Pacjenci muszą również mieć potwierdzoną obecność blaszek amyloidowych w mózgu, co zostanie sprawdzone za pomocą badania obrazowego mózgu (PET w kierunku amyloidu) lub punkcji lędźwiowej (nakłucie lędźwiowe). Uczestnicy muszą ważyć 150 kg lub mniej i mieć osobę towarzyszącą, która będzie wspierać uczestnika w trakcie badania w charakterze partnera w badaniu.
W tym badaniu nie mogą uczestniczyć osoby, u których występują inne choroby mózgu, które mogą wpływać na ich myślenie i pamięć, osoby, u których występują choroby wpływające na mózg i jego naczynia krwionośne i/lub osoby, u których w przeszłości występowały określone choroby psychiczne. Osoby, u których nie można wykonać badania MRI mogą również zostać wykluczone. W badaniu nie mogą też brać udziału osoby, które są w ciąży lub karmią piersią. Mogą istnieć dodatkowe kryteria, które muszą zostać spełnione, co będzie można określić po rozmowie z lekarzem prowadzącym badanie.
3. Jak będzie przebiegać to badanie?
Osoby zostaną poddane ocenie przesiewowej w celu sprawdzenia, czy mogą uczestniczyć w badaniu. Okres przesiewowy będzie trwał ponad 8 tygodni przed rozpoczęciem leczenia.
Jest to badanie z grupą kontrolną otrzymującą placebo. Oznacza to, że uczestnicy zostaną przydzieleni do grupy, która będzie otrzymywać lek lub do grupy, która będzie otrzymywać placebo (czyli preparat, który nie zawiera aktywnych składników, ale wygląda tak samo jak badany lek i jest przyjmowany w taki sam sposób). Porównanie wyników z różnych grup pomoże badaczom ustalić, czy zaobserwowane zmiany wynikają ze stosowania badanego leku, czy też są przypadkowe.
Pacjenci włączeni do tego badania klinicznego, zostaną losowo (jak przy rzucie monetą) przydzieleni do jednej z dwóch grup. Uczestnicy będą otrzymywać albo trontinemab, albo lek nieaktywny (placebo) w postaci wlewu dożylnego (infuzja dożylna).
Uczestnicy będą mieli równe szanse przydziału do grupy przyjmującej trontinemab i do grupy przyjmującej placebo.
Badanie to jest badaniem prowadzonym metodą podwójnie ślepej próby. Oznacza to, że do zakończenia badania ani uczestnicy badania, ani zespół prowadzący badanie nie będą wiedzieli, jakie leczenie jest podawane uczestnikom. Ma to na celu zapewnienie, że oczekiwania uczestników w stosunku do otrzymanego leczenia nie wpłyną na wyniki leczenia. Lekarz prowadzący badanie może jednak zostać poinformowany, do której grupy przydzielono uczestnika, jeśli jego bezpieczeństwo będzie zagrożone.
W trakcie tego badania uczestnicy będą odbywać wizyty u lekarza prowadzącego badanie. Uczestnicy będą pytani o samopoczucie i pamięć, lekarz przeprowadzi badania stanu zdrowia oraz sprawdzi, czy nie występują u nich działania niepożądane. Uczestnicy odbędą jedną wizytę końcową, podczas której lekarz prowadzący badanie sprawdzi wszystkie parametry oceniane w ramach badania i stan zdrowia uczestnika. Całkowity czas udziału w badaniu wyniesie około 1 rok i 7 miesięcy. Uczestnicy mają prawo przerwać przyjmowanie leczenia w ramach badania i wycofać się z badania w dowolnym momencie, wedle własnego uznania. Po zakończeniu badania uczestnicy, jeśli się zakwalifikują, otrzymają możliwość przystąpienia do otwartego badania kontynuacyjnego, w którym wszyscy będą otrzymywać trontinemab.
4. Jakie są główne wskaźniki mierzone w tym badaniu?
Głównymi wskaźnikami mierzonymi w badaniu w celu oceny, czy lek zadziałał, są zmiany dotyczące pamięci, myślenia i codziennego funkcjonowania od momentu dołączenia do badania do tygodnia 72, określane przy użyciu specjalnie zaprojektowanego zestawu pytań (kwestionariuszy).
Inne kluczowe wyniki mierzone od momentu rozpoczęcia udziału w badaniu do tygodnia 72 za pomocą kwestionariuszy i narzędzi oceny obejmują:
Zmiany dotyczące pamięci i zdolności myślenia
Zmiany dotyczące zdolności danej osoby do wykonywania codziennych czynności
Zmiany dotyczące koncentracji i zdolności wykonywania poleceń
Odkładanie się w mózgu białek (amyloidu i białka tau) oraz stężenie biomarkerów w PMR (płynie mózgowo-rdzeniowym) i krwi. Biomarker to mierzalny wskaźnik, który można znaleźć we krwi lub płynach ustrojowych i który może wskazywać na stan zdrowia
Dodatkowo zostanie zmierzona liczba i nasilenie działań niepożądanych.
5. Czy udział w tym badaniu niesie ze sobą jakiekolwiek zagrożenia lub korzyści?
Udział w badaniu może, ale nie musi sprawić, że uczestnicy poczują się lepiej. Jednakże informacje zgromadzone w ramach badania mogą w przyszłości pomóc innym osobom z podobnymi chorobami.
W czasie prowadzenia badania bezpieczeństwo i skuteczność leczenia w ramach badania mogą nie być w pełni znane. Badanie wiąże się z pewnym ryzykiem dla uczestnika. Jednak zazwyczaj nie jest ono większe niż zagrożenia związane z rutynową opieką medyczną lub naturalnym przebiegiem choroby. Osoby zainteresowane udziałem w badaniu zostaną poinformowane o zagrożeniach i korzyściach oraz o wszelkich dodatkowych procedurach lub testach, którym mogą być poddawane. Wszystkie szczegóły dotyczące badania zostaną opisane w dokumencie świadomej zgody na udział w badaniu. Obejmuje to informacje o możliwych działaniach niepożądanych i innych możliwościach leczenia.
Zagrożenia związane z badanym lekiem
Uczestnicy mogą odczuwać działania niepożądane leku stosowanego w tym badaniu. Te działania niepożądane mogą mieć nasilenie od łagodnego do ciężkiego, w tym mogą zagrażać życiu i mogą się różnić u poszczególnych osób. Podczas trwania badania uczestnicy będą poddawani regularnym badaniom kontrolnym w celu sprawdzenia, czy nie występują u nich żadne działania niepożądane.
Trontinemab
Uczestnicy zostaną również poinformowani o znanych działaniach niepożądanych trontinemabu oraz możliwych działaniach niepożądanych na podstawie badań z udziałem ludzi i badań laboratoryjnych lub wiedzy o podobnych lekach.
Trontinemab i placebo będą podawane w kroplówce do żyły (wlew dożylny). Do znanych działań niepożądanych związanych z wlewem należą symptomy takie jak gorączka i dreszcze.
Do znanych działań niepożądanych należą także stany zapalne, obrzęk lub niewielkie plamy krwotoczne w częściach mózgu (nieprawidłowości w badaniach obrazowych związane z amyloidem, ARIA).
Badany lek może być szkodliwy dla nienarodzonego dziecka. Kobiety, które mogą zajść w ciążę, muszą podjąć odpowiednie środki ostrożności, aby uniknąć narażenia nienarodzonego dziecka na działanie leczenia podawanego w ramach badania.
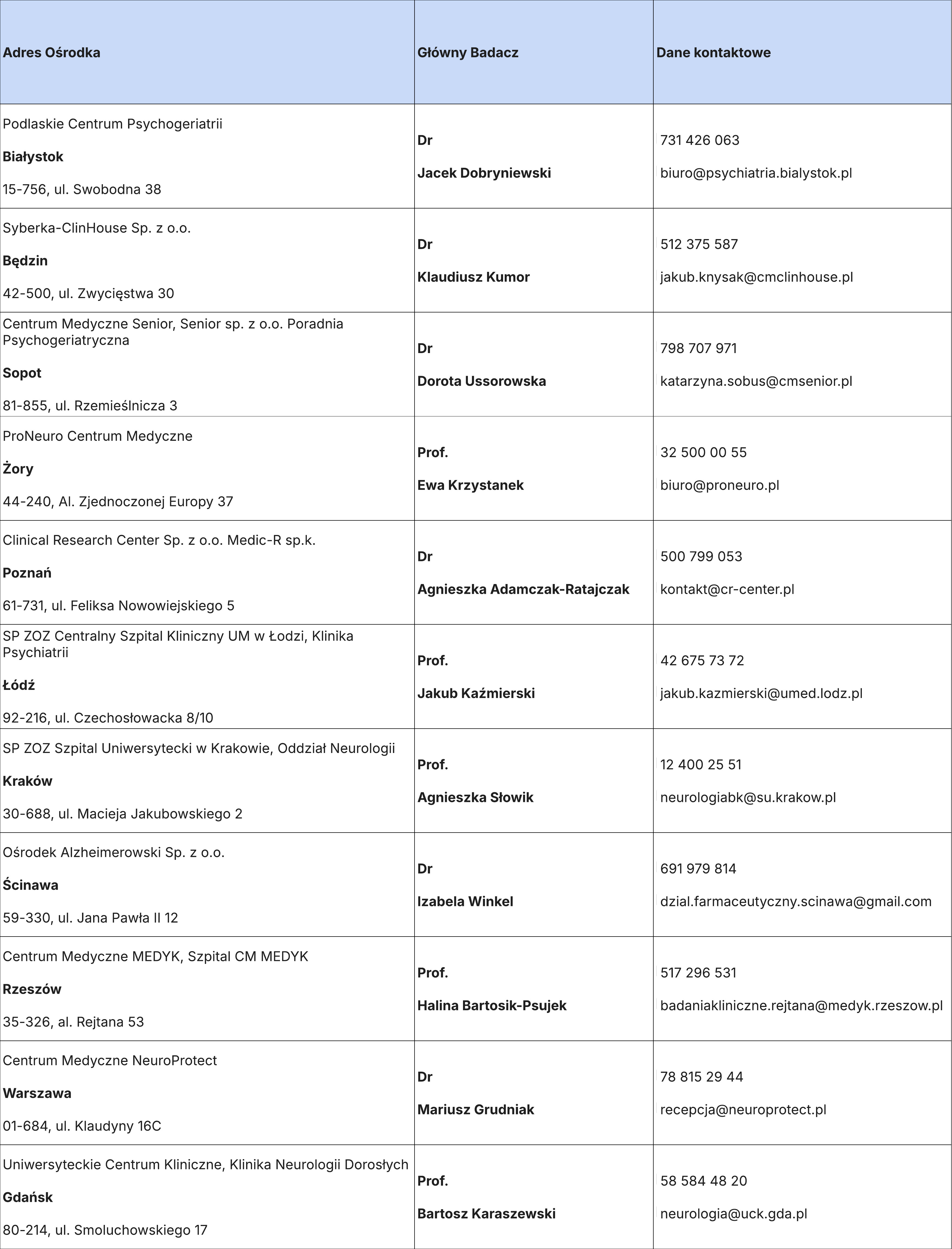
LISTA OŚRODKÓW BADANIA WN45447:
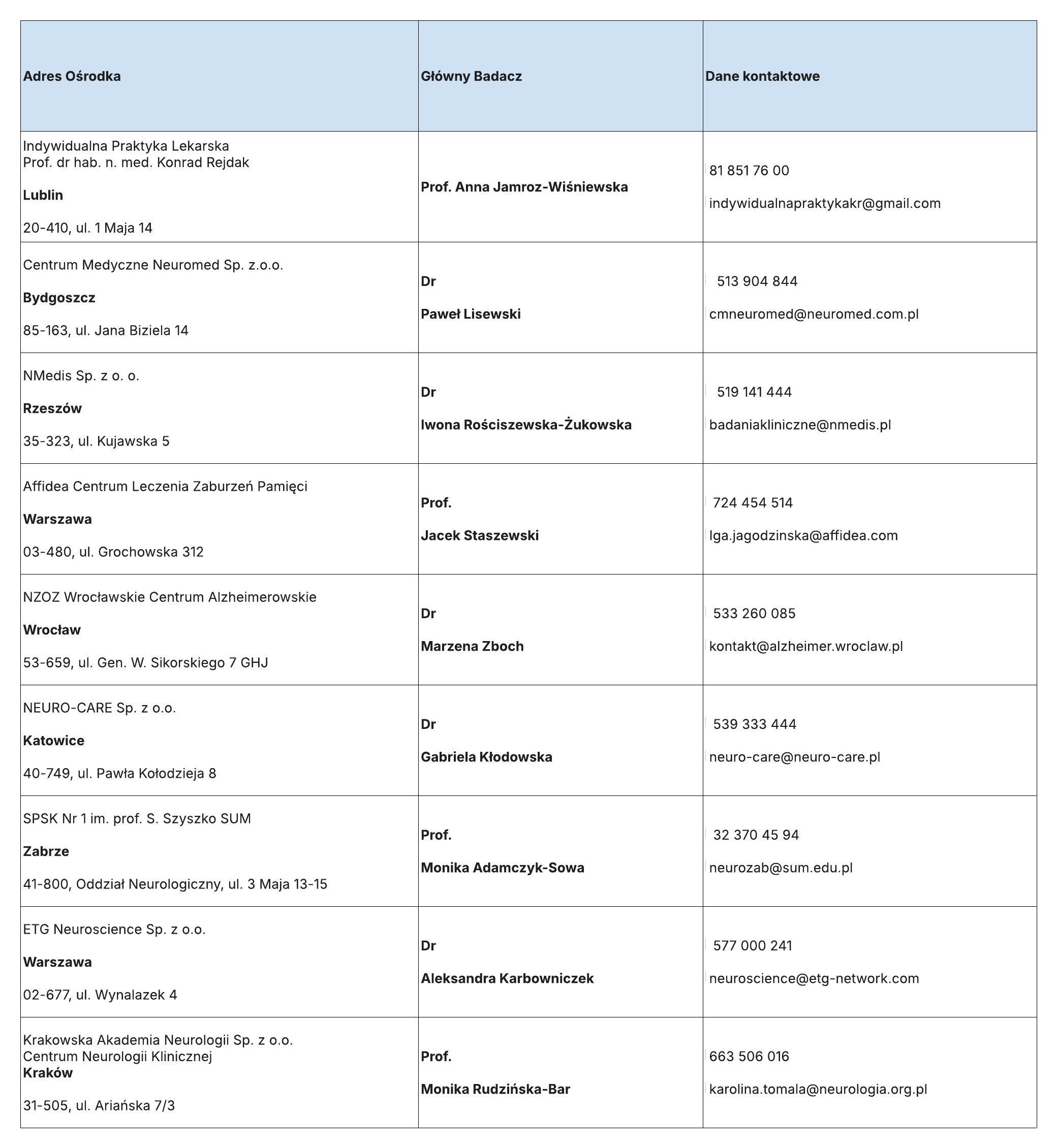
LISTA OŚRODKÓW BADANIA WN45443:
Niniejsza strona zawiera podsumowanie informacji ze stron internetowych rejestrów publicznych, takich jak ClinicalTrials.gov, EuClinicalTrials.eu, ISRCTN.com itp. Więcej informacji na temat tego badania można znaleźć w zakładce Dla personelu medycznego lub na jednej z wymienionych stron internetowych.
Informacje pochodzą bezpośrednio ze stron internetowych rejestrów publicznych, takich jak ClinicalTrials.gov, EuClinicalTrials.eu, ISRCTN.com itp. i nie były edytowane.
Results Disclaimer

